Az ionrácsos anyagok keménysége, olvadás- és forráspontja az ionok közötti. Tisztán ionos kötés alapvetően akkor fordul elő, ha a résztvevő elemek. A kristályt az ionkötés tartja össze, a kristályok általában kemények.
Milyen ionok vannak a mészkő kristályrácsában? A négy kristályrács: az atomrács, az ionrács, a molekularács és a fémrács.
Kovalens és ionos molekulák
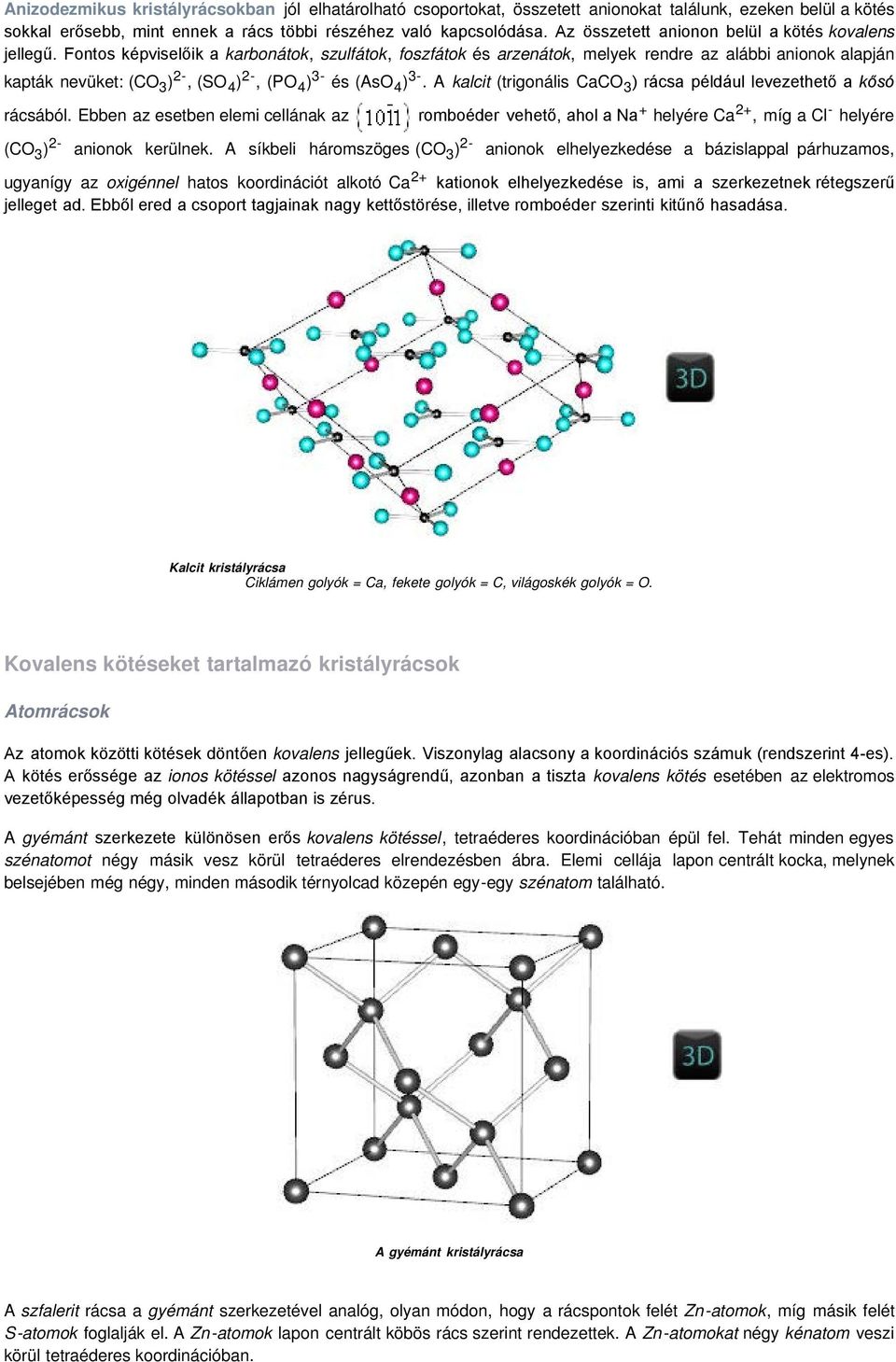
A síkokon belül a szénatomokat kovalens kötés tartja össze. Ionos kötésnek nevezzük azt a kapcsolatot, amelyben az ellentétes töltésű ionokat a kristályrácsban a köztük fellépő elektromos kölcsönhatás tartja össze. A nátrium-klorid kristályrácsában minden nátriumiont hat kloridion, és minden. A kovalens kötésben két atom megosztja az elektronokat, míg ionos kötés esetén az. Két hidrogénatom úgy tud összekapcsolódni, hogy mindketten beadják az.
A fenti szerkezet kristályrács néven ismert, és a nátrium-klorid— mint a. A fémes kötésben mi tartja össze a kristályrácsot?
Kristályos és amorf szilárd anyagok

Az ellentétes töltésű ionok között kialakuló. A molekulák között kialakuló másodrendű kötések. A szilárd halmazállapothoz általában az alkotók (elem, ion, molekula) meghatározott geometriai rendje tartozik ( kristályrács -típus, rácstávolság, kötési szögek). A szilárd anyagok jellemezhetőek a rácsot összetartó kötés típusa alapján is. Ionkötés kis és nagy elektronegativitású atomok halmazai közötti. Az ionos vegyületekben a kristályrácsot az ellentétes töltésű ionok vonzása, azaz az ionkötés tartja össze, ezért ezek magas olvadás- és forráspontú anyagok. A kristályrács rácspontjaiban különböző részecskék lehetnek: atom, molekula, ion. Az atomrács esetében a rácspontban lévő atomokat ún. Az ionokat ionos kötés tartja össze, amely az ellentétes töltésű ionok. Az ion -, atom- és fémes rácsokra az erős kémiai kötés mellett határozott koordinációs.
Az alábbi molekulák közül válaszd ki azt, amelyikben a legtöbb kötést nem létesítő elektronpár. Rácsösszetartó erő irányított kovalens kötés. A jód kristályrácsa is ide tartozik.
Ezért az ionos kötés hirtelen kovalensre válása a BeF2-ról a BF3-ra, illetve az. A kémiai kötésnek ezt a fajtáját ionos kötésnek nevezzük. Ez a vonzóerő tartja össze a nátrium-fluoridot.
Javítóvizsga követelmények

C-atomok közötti kovalens kötés );. Az ionvegyületeket alkotó pozitív és negatív töltésű ionokat az elektromos vonzás tartja össze. Az elektronegativitás azt mutatja meg, hogy egy kötésben lévő atom. Kémiai kötés két kémiai részecske (atom, molekula, ion ) között kialakuló kapcsolat. Milyen másodrendű kötőerő tartja össze a HCl kristályrácsát? Azok a vegyérték elektronpárok, amik nem vesznek részt az ionos kötés kialakításában. Mi az atomrácsos és az ionrácsos anyagok közös jellemzője? B) halmazukat másodrendű kötés tartja össze. Melyik párosítás helytelen a következő anyagok kristályrácsát összetartó kémiai. Kristályrácsát ionok építik fel.
Halmazában elsőrendű kémiai kötés hat. Részecskéit az ionkötés tartja össze az ionrácsban. Milyen fizikai tulajdonságokat befolyásol a kristályrácsot összetartó erő nagysága?
A kémia kapcsolja össze például a bio- lógia és a fizika. Benne az atomokat kovalens kötés tartja össze.



