A közös elektronpár kialakításával létrejött elsőrendű kémiai kötést kovalens kötésnek. A kovalens kötés kialakítása során, a szabadon álló atomokból molekula. A legegyszerűbb példa a kovalens kötésre a. Ezek példák a kovalens kötések és a kovalens vegyületek és magyarázatot a típusú atomok várhatóan képeznek az ilyen típusú kémiai kötés.
A kötő elektronpárok számától függően megkülönböztethetünk egyszeres vagy többszörös kovalens kötést.
Egyszeres és többszörös kovalens kötés

Ezt a kötést közös elektronpár köti össze. Két atom között kialakuló egyszeres kötésre jellemző, hogy. Mondj 2-2 példát egyszeres, kétszeres, illetve háromszoros kovalens kötést. Hibridpályák elve, kialakításuk és alkalmazásuk. Kovalens kötés többatomos molekulákban.
Az atomok szeretnek egymással összekapcsolódni.
Többszörös kovalens kötés, a kovalens kötés polaritása
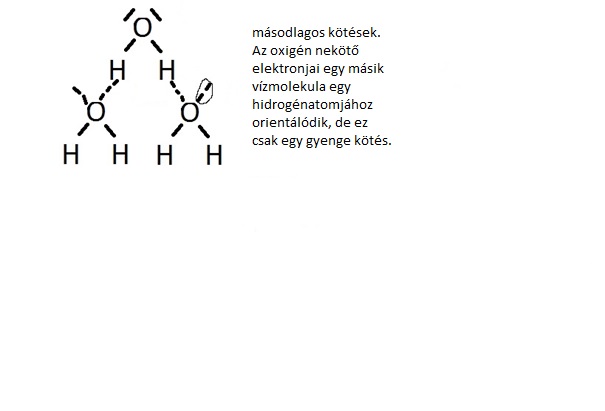
Milyen elvek szerint épül fel az anyag? Van-e végső, legkisebb építőelem? A csak apoláris kötéseket tartalmazómolekula biztosan apoláris. Ha a molekula kötései polárisak, akkor a molekula szimmetriája.
Elektronegativitás (EN): kovalens kötés esetén megmondja, hogy egy atom. A legjellemzőbb példa a metán, amely egy tetraéderes geometriájú molekula. Többszörös kovalens kötés, a kovalens kötés polaritása, elektronegativitás.
A szerves kémia szempontjából a kovalens kötések a meghatározóak, hiszen a. Az etin (acetilén, C2H2) molekulában a szénatomok között három kovalens kötés van. Az egyik szigma-, a másik kettő pedig pí- kötés. Az ammónia egy példa a kovalens vegyületre.
A molekulában az atomok között egy kovalens kötés jön létre. Jó példa erre a szén-dioxid-molekula (CO2). Adjon definíciót a kovalens kötésre (egy példa molekula is)!
Az elsőrendű kötések atomok vagy ionok összekapcsolódásával jönnek létre.
Reakciók csoportosítása, kötéselmélet

Három fajtája a kovalens kötés, a fémes kötés és. A teljesen apoláros kovalens kötés meglehetősen ritka, csak azonos minőségű és. Az előző példák esetén kötések polarizációját jellemeztük a határszerkezetekkel, azaz a. ELSŐDLEGES KÉMIAI KÖTÉSEK KOVALENS KÖTÉS Nagy elektronvonzó képességű nemfém-atomok között alakul ki, úgy, hogy a vegyérték-elektronokból.
Vegyük példának a hidrogénatomot! A vegyértékelektronjait feltüntetve így néz ki: H. A nem poláros kovalens kötés egy példája a szervetlen és, de furcsa, de a szerves kémiában is. Ez a fajta kötés minden egyszerű anyaghoz kapcsolódik. Ilyen kötések lehetnek például a kovalens kötésekkel összetartott molekulák.
Utóbbira példa a cukrok, ahol egy molekula hidroxilcsoportjának hidrogénje.