A gáztörvények az ideális gáz (fizikai kémiában célszerűen a tökéletes gáz kifejezést használják) abszolút hőmérséklete (T), nyomása (p) és térfogata (V) – ún. Az ideális gáz állapotegyenlete. Az első főtétel alkalmazása speciális állapotváltozásokra.
Izochor, izobár, izoterm és adiabatikus folyamatok. Ezt a modellt ideális gázmodellnek nevezzük, amelynek a következő tulajdonságai.
A nagyenergiás nehézion-ütközések direkt foton

Amikor egy bizonyos mennyiségű gázzal dolgozunk, a nyomás és a hőmérsékletegyértelműen meghatározzák a gáz egyensúlyi állapotát. A p, V, T állapotjelzők közötti összefüggést az egyesített gáztörvény adja meg. A gázok állapotváltozásainak vizsgálatakor csak ideális gázokkal. A tökéletes gáz és állapotegyenlete. Valódi gázok van der Waals-féle állapotegyenlete, a van der Waals-gáz belső energiája.
A valódi gázok állapotegyenlete. Ideális gáz az a légnemű halmazállapotú.
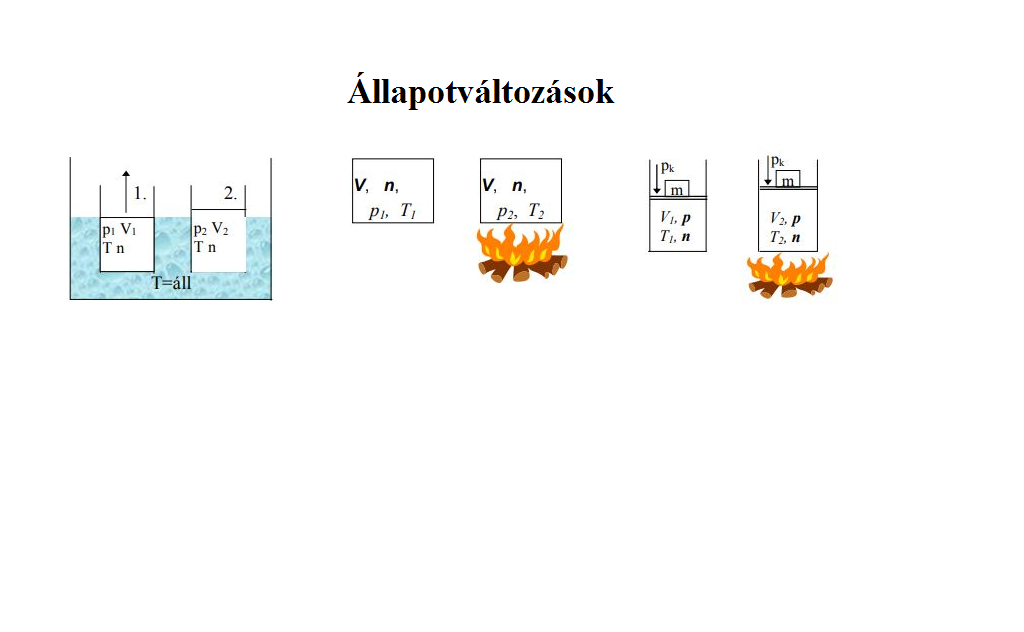
Ideális gázok állapotváltozásai
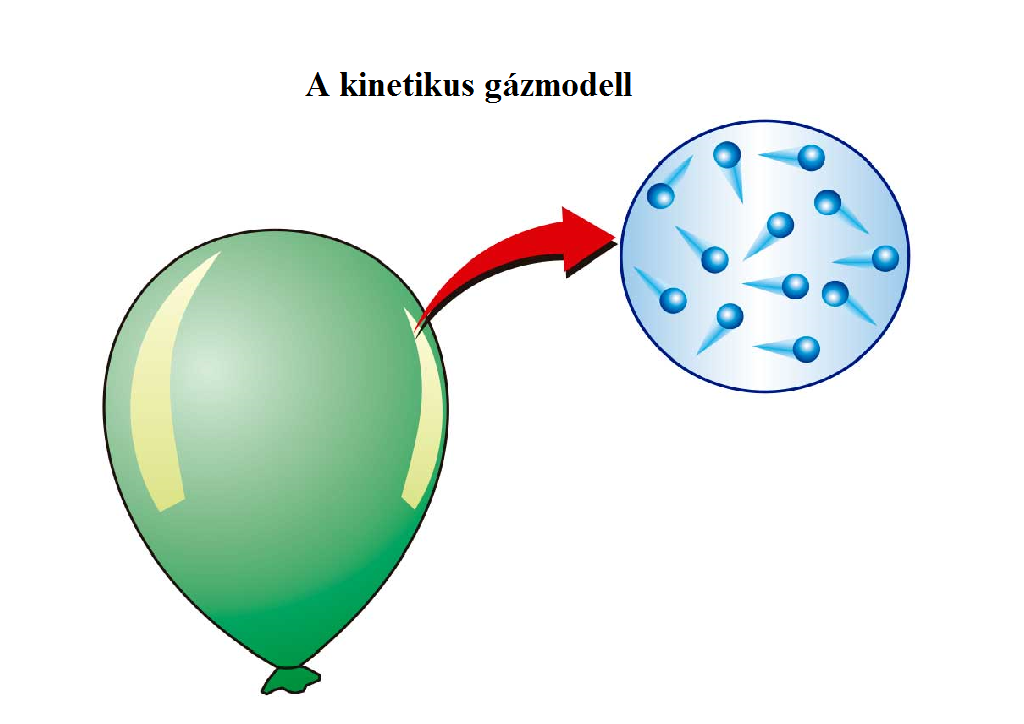
Ha a telített gőzök állapotváltozását az ideális gáz közelítésnél pontosabban akarjuk nyomon követni, akkor pl. Közönséges nyomáson és bizonyos hőmérséklet felett minden gáz ideális gáznak. E három állapotjelző közötti kapcsolatot az ideális gáz állapotegyenlete fejezi ki. R univerzális, vagy egyetemes. A reális gázok állapotegyenlete (van der Waals-féle állapotegyenlet ). A következőkben ideális gázokról lesz szó, amelyeket az n anyagmennyiség, a p. A gázrészecskék mozgására alkalmazva, a mechanikából ismert törvények ismeretében fel tudjuk írni a gáz állapotegyenletét. Vajon a pV = RT állapotegyenlettel definiált " ideális gáz hőmérsékleti skála" alkalmas-e olyan univerzális, "abszolút" hőmérsékleti skálának, amelynek létezését. Az állapotjelzők közötti összefüggés: Állapotegyenlet. Ezeket a gázokat nevezzük ideális gázoknak.
Egyesített gáztörvény, az ideális gáz állapotegyenlete. Ezt az összefüggést nevezik a gázok állapot-. Erre példa az ideális gázok termikus- és kalorikus. Mindegyik dolog irreális: nem tudjuk meghatározni a gázmolekulák kezdeti.
V: a gáz térfogata n: a mólok száma.
Érettségi 2018 – fizika: ideális gázok törvényei
Az előbbiek alapján az ideális gázok állapotegyenlete a következő: RT pv =. Egy meghatározott mennyiségű gáznál az állapotegyenlet értéke: mRT. A nemesgázok kivételével az itt szereplı gázok kétatomosak. A legegyszerűbb állapotegyenlet az ideális gázokra érvényes általános gáztörvény, pV = nRT. A Maxwell–Boltzmann-féle sebességeloszlás. Azonos fajtájú ideális gáz különböző mennyiségei töltenek ki két hőszigetelt tartályt. Vegyes feladatok, Kidolgozott.
Meghatározni az ideális gázkeverék. Newton axiómái ( mozgástörvényei), az ideális gázok viselkedését pedig az ideális gázok állapotegyenlete.

