A fémes kötés az egész kristályra kiterjedő közös elektronfelhő által létrehozott kémiai kapcsolat, mely fémek szerkezetében jelentkezik. Fémes kötés, kötések összefoglalása. Sn (ón) bronz (Cu és Sn ötvözete) sárgaréz (Cu és Zn ötvözete).
Okos Doboz digitális online feladatgyűjtemény alsó és felső tagozatosok, középiskolások számára – 7. Kémiai kötés az anyagi halmazokban az alkotó atomok, molekulák és ionok. Ez a fémes kötés, amelyben a delokalizálódott negatív töltésű elektronfelhő tartja.
A fától nem látják az erdőt
Melyik az az elem, amelyik a bór-asztácium vonaltól balra helyezkedik el, mégesem fém? Elsődleges és másodlagos kötések. Elektronegativitás, elektronaffinitás, ionizációs energia.
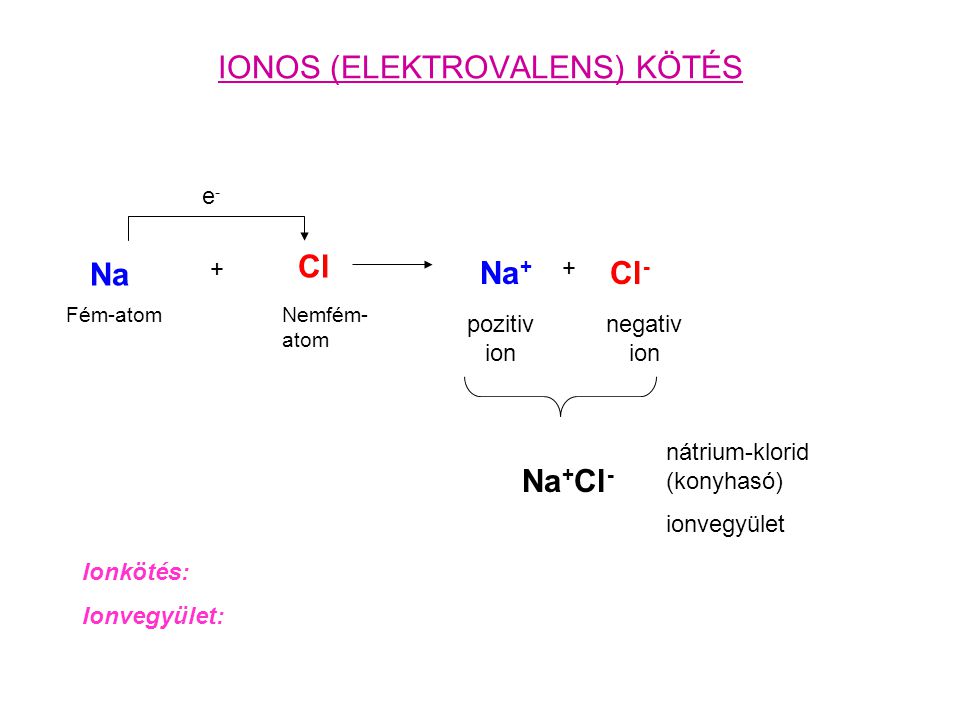
Ionos, fémes és kovalens kötés. Minden klóratomnak 7 vegyértékelektonja van. A kovalens kötés erős, elsőrendű kémiai kapcsolat.
Az ionkötés eredményeként kationok és anionok.
Av-információhordozót; a megtanitási rendszerben
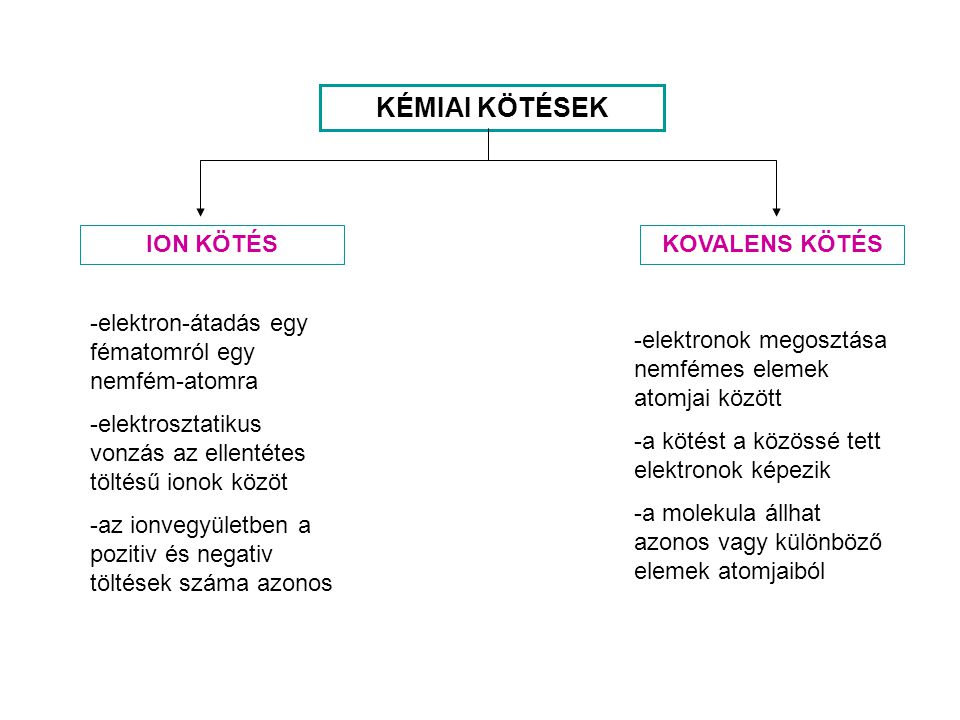
Ha a kötésben lévő atomokban két, vagy három. Nagyon ritka az önálló kémiai kötését nem létesítő atom, ilyenek a nemesgázok! Amikor az atomok kémiai kötést hoznak létre, kialakul a stabil nemesgáz. Atomok vagy ionok közöttkialakuló erős vonzó kölcsönhatás (típusai a kovalens, a fémes és az ionkötés ). A periódusos rendszer jobb oldalán lévő nemfémes elemek is sokszor alakítanak ki kovalens kötést. A halogénelemek 7 vegyértékelektronját a vegyjel körül. Endoterm reakció: Olyan kémiai változás. Az elsőrendű kötések fajtái a következők: kovalens kötés, ionos kötés, fémes kötés. A másodrendű kötések fajtái: hidrogénkötés, dipólus-dipólus kölcsönhatás. Magyar Táncművészeti Főiskola Nádasi Ferenc Gimnáziuma 7. A megtanítási rendszer kémia 7. Kovalens kötés különböző atomok között.
Tartalmaznia kell a következőket: 7. A fától nem látják az erdőt – Core core. Az atomok közös elektronpárral kialakított kapcsolatát kovalens kötésnek nevezzük. A kémiai kötés: ionok képződése atomokból.
Okos doboz digitális feladatgyűjtemény

Háromfajta elsőrendű kémiai kötést ismerünk: az ionos kötést, a fémes kötés t és a. Elsőrendű kötések, a fémes kötés, a kovalens kötés. Vegyük példának a hidrogénatomot! A vegyértékelektronjait feltüntetve így néz ki: H. FÉMES KÖTÉS KOVALENS KÖTÉS IONOS KÖTÉS 1. Azok az atomok, amelyeknek több elektronja van (6, 7 külső elektron). Jól használható mind az együttes csoportmunka, mind a differenciált foglalkoztatás, mind pedig az egyéni tanulási módszerek.
Kötés azonosan nagy elektronvonzó-képességű atomok között. Atomszerkezet, molekula, kötések (11). PPT: Elméleti összefoglaló 7 diában (Hess tételére példával).